-
Produkty
- Przyrządy laboratoryjne
-
Mierniki i elektrody laboratoryjne
Wzorce do kalibracji Mierniki i sondy Sension+
- Chemikalia, reagenty i wzorce
-
Online Analysers
Analizatory azotu amonowego Analizatory chloru
- CL17sc
- Amperometryczny CL10 sc
- Amperometryczny 9184 sc
- Analizator kolorymetryczny chloru CL17sc do pomiarów bardzo niskiego zakresu
Analizatory serii EZ- Żelazo
- Aluminium
- Mangan
- Fosforany
- Chlorki
- Cyjanki
- Fluorki
- Siarczany
- Siarczki
- Arsen
- Chrom
- Miedź
- Nikiel
- Cynk
- Azot amonowy
- Azot całkowity
- Fosfor całkowity
- Fenol
- Lotne kwasy tłuszczowe
- Zasadowość
- ATP
- Twardość
- Toksyczność
- Preparowanie próbek
- Boron
- Colour
- Nitrate
- Nitrite
- Silica
- Hydrogen Peroxide
- EZ Series Reagents
-
Czujniki i regulatory online
Przetworniki cyfrowe Przetworniki (analogowe) Ammonium Sensors Czujnik do monitorowania siarkowodoruCzujniki pH i ORP
- 12 mm pH/Redox
- 1200-S Redox
- 1200-S pH
- Cyfrowa dyferencyjna ORP
- Cyfrowa dyferencyjna pH
- Dyferencyjna pH
- Kombinowana pH/ORP
- LCP ORP
- LCP pH/ORP
- 9525 DCCP System
- Analogowa indykcyjna 3700
- Analogowa kontaktowa 3400
- Bezelektrodowa 3798 sc
- Cyfrowa kontaktowa 3400
- Przewodność kationowa 9523
- Automatyczne systemy laboratoryjne
- Claros Water Intelligence System
-
Mikrobiologia
Akcesoria i chemikalia Gotowe pożywkiPożywki odwodnione Sprzęt laboratoryjny
- Pobieranie próbek
- Zestawy i paski testowe
-
Wyposażenie laboratoryjne i dostawy
Książki i materiały referencyjne Ogólnie materiały eksploatacyjne do laboratoriumWyroby szklane/Wyroby z tworzyw sztucznych
- PARAMETRY
-
Rozwiązania softwarowe
-
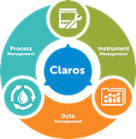
Claros Water Intelligence System
Główne produkty Process Management
- Rozwiązania do:
- Usuwania związków węgla organicznego/ChZT
- Denitryfikacji naprzemiennej
- Usuwania fosforu
- Gospodarki osadami
Data Management- Rozwiązania do:
- Gromadzenia
- Wizualizacji i analizy
- Raportowania
- Zapewniania dokładności
Instrument Management- Rozwiązania do:
- Konserwacji
- Rozwiązywania problemów
- Dostępu zdalnego
- Porównywania metod laboratoryjnych i procesów
-
Claros Water Intelligence System
- Branże
- Serwis
- Nowości i wydarzenia
Polska
Wybierz swój kraj lub region:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
Middle East - Africa
Amoniak i jon amonowy
Czym jest amoniak?
Amoniak jest bezbarwnym, drażniącym związkiem gazowym wodoru i azotu (jeden atom azotu i trzy atomy wodoru, NH3), który jest dobrze rozpuszczalny w wodzie.
Amoniak powstaje w naturalny sposób jako produkt mikrobiologicznego rozkładu azotowych substancji organicznych (białka zwierzęcego i roślinnego). Może być również produkowany do stosowania w nawozach lub do produkcji tworzyw sztucznych, środków farmaceutycznych i innych środków chemicznych.
Amoniak w wodzie gruntowej jest czymś normalnym ze względu na procesy mikrobiologiczne. Jednakże obecność azotu amonowego w wodzie powierzchniowej zwykle wskazuje na zanieczyszczenie pochodzące z gospodarstw domowych. Nadmiar amoniaku może uszkadzać roślinność i jest niezwykle toksyczny dla organizmów wodnych, zwłaszcza przy podwyższonych poziomach pH i temperatury.
Woda amoniakalna
W różnych zastosowaniach amoniak rozpuszcza się w wodzie, tworząc „wodę amoniakalną”. Wodne roztwory amoniaku (woda amoniakalna) są niestabilne, a stężenie amoniaku może spadać podczas transportu lub przechowywania. Dlatego roztwory dostarczane w handlu są rozliczane na podstawie stężenia amoniaku dostarczanego do zakładu lub użytkownika końcowego.
Czym jest jon amonowy?
Amon jest związkiem zawierającym jeden atom azotu i cztery atomy wodoru (NH4+). Chociaż amoniak jest obojętną molekułą niezjonizowaną (słabą zasadą), amon jest jonem o ładunku dodatnim. Ponadto amoniak wydziela silny zapach, natomiast amon w ogóle nie wydziela zapachu.
Głównym czynnikiem określającym stosunek amoniaku do amonu w wodzie jest pH. Na aktywność amoniaku ma również wpływ siła jonowa i temperatura roztworu. Należy pamiętać, że choć amoniak cząsteczkowy amoniak może być szkodliwy dla organizmów wodnych, to jon amonowy jest zasadniczo nieszkodliwy. W gospodarce wodnej ważne jest, aby znać stężenia azotu związanego z wodorem. Dlatego określenia amoniak i amon są używane zamiennie, przedstawione odpowiednio jako NH 3 -N lub NH 3 -N i zwykle wyrażone w mg/L lub PPM N (części N na milion).
Równanie chemiczne, które obrazuje zależność między amoniakiem a jonem amonu, jest następujące:
NH 3 + H 2O <-> NH 4 + + OH -
Gdy wartość pH jest niska, równowaga przesuwa się w prawą stronę, a gdy wartość pH jest wysoka, równowaga przesuwa się w lewo. Ogólnie w środowisku o temperaturze pokojowej i o pH niższym od 6, część azotu amonowego pod postacią NH 3 jest bardzo mała, a prawie cały azot amonowy występuje jako NH 4 +. Przy wartości pH około 8, część NH 3 wynosi 10 procent lub mniej, a przy wartości pH nieco powyżej 9 wynosi około 50 procent. Gdy wartość pH jest > 11, wszystkie jony amonowe w roztworze zostaną przekształcone w molekularną postać amoniaku. W niskich temperaturach aktywność wodnego roztworu amoniaku jest znacznie niższa.
Dlaczego należy monitorować amoniak?
Amoniak jest wykorzystywany zarówno jako odczynnik, jak i jako parametr pomiarowy w kilku obszarach oczyszczania wody i ścieków.
- W wodzie źródlanej monitoruje się naturalnie występujący amoniak.
- Podczas procesu dezynfekcji chlorowej amoniak łączy się z chlorem w celu uzdatniania wody pitnej i utrzymywania trwałych wartości tych związków w systemach dystrybucji.
- Czasami amoniak jest używany do regulacji pH, np. w przemyśle farmaceutycznym.
- Amoniak jest szeroko monitorowany w procesach nitryfikacji i denitryfikacji ścieków.
Choć zasadniczo jest on nieszkodliwy w niskich stężeniach, wysokie stężenia amoniaku mogą powodować uszkodzenia i stanowić zagrożenie dla zdrowia. Dlatego też poziomy amoniaku muszą być odpowiednio monitorowane i utrzymywane.
Firma Hach® oferuje sprzęt, zasoby, szkolenia i oprogramowanie, które są niezbędne do skutecznego monitorowania i zarządzania poziomami amoniaku w danym zastosowaniu procesowym.
Polecane produkty do monitorowania amoniaku
Łatwe w obsłudze, wytrzymałe i przenośne urządzenia firmy Hach są skonstruowane tak, aby radzić sobie z obciążeniami występującymi w zastosowaniach polowych.
Kup terazMultimetr laboratoryjny HQ440D firmy Hach to zaawansowany miernik laboratoryjny, który eliminuje niepewność przy pomiarach.
Dowiedz się więcejElektrody jonoselektywne Intellical (ISENH)
Mierniki HQD ® łączą się z inteligentnymi elektrodami IntelliCAL ®, które automatycznie rozpoznają parametr testowy.
Dowiedz się więcejUrządzenia z serii HQ są przeznaczone dla specjalistów ds. jakości wody, którzy wykonują analizy elektrochemiczne w terenie i w laboratorium.
Dowiedz się więcejCyfrowy analizator Amtax sc firmy Hach z elektrodą gazoczułą jest przeznaczony do bardzo precyzyjnego oznaczania stężenia bezpośrednio w procesie uzdatniania (instalacje zewnętrzne).
Dowiedz się więcejAnalizatory online z serii EZ zapewniają wiele możliwości monitorowania amonu w wodzie.
Dowiedz się więcejCyfrowa sonda jonoselektywna A-ISE sc firmy Hach jest przeznaczona do oznaczania stężenia amonu bezpośrednio w medium.
Dowiedz się więcejCyfrowy czujnik kombinowany AN-ISE sc firmy Hach do oznaczania amonu i azotanów służy do ciągłych bezpośrednich pomiarów przy użyciu elektrody jonoselektywnej.
Dowiedz się więcejPrzyrząd do analiz równoległych Hach SL1000 (PPA) umożliwia wykonywanie testów z pominięciem połowy czynności wykonywanych podczas pomiaru ręcznego.
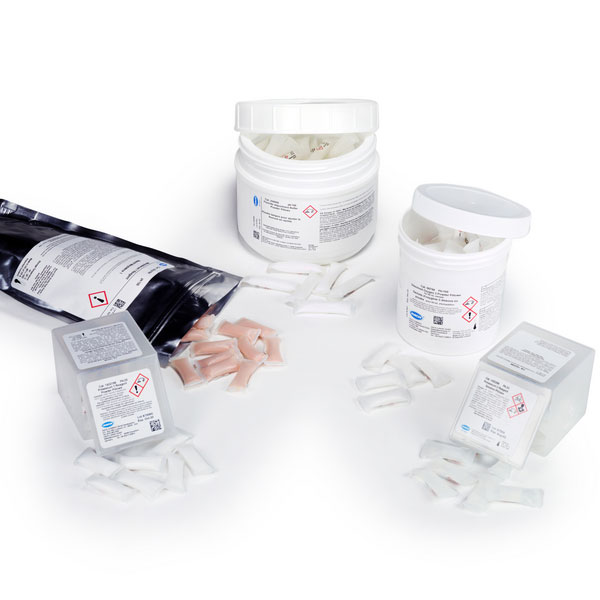
Dowiedz się więcejOdczynniki do badania amoniaku wolnego i ogólnego
Firma Hach zapewnia wysokiej jakości odczynniki do rutynowych i specjalnych analiz wody.
Dowiedz się więcej
Które procesy wymagają monitorowania amoniaku?
Oczyszczanie wody pitnej
Z amoniakiem gazowym i jego stężonymi roztworami należy obchodzić się ostrożnie i zgodnie z obowiązującymi przepisami. Jest to spowodowane wysoce żrącymi właściwościami, które stanowią poważne zagrożenie dla zdrowia, od łagodnego podrażnienia oczu lub skóry do poparzenia chemicznego, w zależności od stężenia. Ponadto amoniak pochodzący z odgazowania może powodować problemy estetyczne, takie jak nieprzyjemny smak lub zapach.
Jeśli amoniak nie jest używany do dezynfekcji, jego obecność w systemie dystrybucji może wskazywać na wycieki substancji z materiałów użytych w budowie rurociągu lub skażenie wody z powodu uszkodzenia systemu. Połączenie niepożądanego amoniaku z chlorem ogranicza skuteczność dezynfekcji chlorowej.
Chloraminacja
W niektórych procesach dezynfekcji amoniak jest celowo łączony z chlorem w celu wytworzenia monochloraminy. Choć wolny chlor jest skuteczniejszym środkiem dezynfekującym, monochloramina (związany amoniak i chlor) jest substancją trwalszą, dzięki czemu pozostaje dłużej w systemie dystrybucji, zapewniając utrzymanie skuteczności dezynfekcji w całej instalacji aż do kranu. Ponadto chloroaminy reagują mniej intensywnie z różnymi zanieczyszczeniami w nieuzdatnionej wodzie, zwłaszcza substancjami organicznymi, ograniczając w ten sposób powstawanie niektórych rakotwórczych produktów ubocznych dezynfekcji (DBP). W celu optymalizacji procesu chloraminacji należy monitorować tworzenie docelowych środków odkażających, jednocześnie zapobiegając powstawaniu mniej pożądanej dichloroaminy lub trichloroaminy (trichlorku azotu). Badanie monochloraminy stosuje się wraz z oznaczaniem wolnego amoniaku w celu stworzenia właściwego środka dezynfekującego i zmniejszenia kosztów surowców poprzez zapobieganie dozowaniu zbyt dużej ilości chloru i/lub amoniaku.
Dowiedz się więcej o chloraminacji.
Wolny amoniak
Amoniak, który nie związał się z chlorem podczas dezynfekcji chloraminacyjnej, określa się jako wolny amoniak (zarówno NH 4 +, jak i NH 3). Przy neutralnym pH i neutralnej temperaturze otoczenia prawie cały wolny amoniak występuje w postaci NH 4 +. Wraz ze wzrostem pH i temperatury zwiększa się ilość NH3 i maleje ilość NH 4 +. W przypadku doprowadzenia wody poddanej chloraminacji stężenie wolnego amoniaku wzrasta, ponieważ monochloramina reaguje z różnymi związkami organicznymi i bakteriami w wodzie systemu dystrybucji, zaspokajając zapotrzebowanie na chlor. Podwyższony poziom wolnego amoniaku wskazuje na początek nitryfikacji. Nagły spadek ilości wolnego amoniaku sugeruje, że proces nitryfikacji trwa i powstają azotyny. Wartość stężenia wolnego amoniaku jest przydatna przy określaniu ilości wolnego chloru potrzebnego do zwiększenia pozostałości monochloraminy w stacji wspomagającej. Poziom wolnego amoniaku można zmniejszyć, dodając wolny chlor w stosunku 5:1 jako Cl2:N, aby ułatwić proces i zminimalizować potencjał nitryfikacji.
Amoniak ogólny
Amoniak ogólny to suma azotu amonowego obecnego w postaci monochloraminy (NH 2Cl -), innych form chloraminy, jonów amonowych (NH 4 +) i amoniaku molekularnego (NH 3). Ten parametr może służyć jako weryfikacja pierwotna lub wtórna wykorzystywana do utrzymania kontroli nad procesem chloraminacji.


Uzdatnianie wody powierzchniowej/gruntowej
Amoniak powstaje jako produkt uboczny procesu rozkładu naturalnych substancji w glebie przez bakterie. Wysokie stężenie amoniaku może być spowodowane przez glebę bogatą w żelazo, bliskość lasu lub dużą ilość nawozu albo skażenie odchodami.

Oczyszczanie ścieków
Podczas oczyszczania ścieków stężenie amoniaku może osiągnąć bardzo wysoki poziom w wyniku działania bakterii. Amoniak jest najpierw przekształcany na azotany w procesie nitryfikacji, tak aby można go było zredukować do azotu atmosferycznego (N2) poprzez denitryfikację. Dowiedz się więcej na temat oczyszczania ścieków komunalnych. Przy wysokich stężeniach i współczynniku pH amoniak może być toksyczny dla drobnoustrojów rozkładających osad. Ponadto, aby zapobiec narażeniu organizmów wodnych, należy monitorować i usuwać amoniak ze ścieków, zanim zostanie on uwolniony do wód naturalnych

Akwakultura
Jako produkt odpadowy organizmów wodnych amoniak może być toksyczny dla ryb i roślin wodnych przy poziomie zaledwie 0,5 mg/L. W zrównoważonych biologicznie akwariach amoniak jest szybko zamieniany na azotyny, a ostatecznie azotany. W większości akwariów dąży się do osiągnięcia zerowego poziomu amoniaku.
W naturalnych środowiskach wodnych wysoki poziom amoniaku może powodować nadmierny wzrost glonów, który blokuje światło słoneczne, pogarszając w ten sposób możliwości wzrokowego poszukiwania pokarmu i ograniczając fotosyntezę.

Rolnictwo
Ponieważ rośliny nie mogą pobierać azotu bezpośrednio z atmosfery, polegają na bakteriach dostarczających azot, które przekształcają azot w amoniak. Azot w postaci amoniaku może być następnie wykorzystywany przez rośliny do tworzenia innych niezbędnych cząsteczek organicznych potrzebnych organizmom złożonym. W celu wspomagania lub wzmocnienia tego naturalnego procesu (który jest częścią cyklu azotowego) do nawozów często dodaje się amoniak. Na przykład roztwory składników pokarmowych stosowane w uprawach hydroponicznych wprowadzają azot w postaci soli amonowej. Amoniak może być również obecny w glebie z powodu dozowania mocznika i jego późniejszego rozkładu.

Produkcja farmaceutyczna
W przemyśle farmaceutycznym amoniak jest używany do kontroli pH, a jego roztwór jest wykorzystywany do regeneracji żywic o słabej wymianie jonowej i do regulacji pH.
W jaki sposób monitorowany jest amoniak?
Metoda wykorzystująca salicylan
Metoda wykorzystująca salicylan jest odmianą dobrze znanej metody wykorzystujące fenat, ale jej zaletą jest eliminacja soli rtęci i fenolu. Metoda ta jest najbardziej przydatna przy oznaczaniu azotu amonowego w niskim zakresie stężeń. Mimo że procedura obejmuje wiele etapów przed ostatecznym osiągnięciem zielonego koloru, wszystkie odczynniki znajdują się w wygodnych w użyciu saszetkach z proszkiem (opakowania saszetek sproszkowanego odczynnika salicylanu i opakowania saszetek cyjanuratu alkalicznego) lub w testach kuwetowych LCK.
- Związki amoniaku reagują z podchlorynem, tworząc monochloraminę.
- Następnie monochloramina reaguje z salicylanem, tworząc 5-aminosalicylan.
- Utlenianie 5-aminosalicylanu następuje w obecności katalizatora, nitroprusydku (zwanego również nitrożelazocyjankiem), co prowadzi do powstania indosalicylanu, związku w kolorze niebieskim. Niebieski kolor jest maskowany przez kolor żółty (z powodu nadmiaru nitroprusydku), co powoduje powstanie roztworu w kolorze zielonym. Intensywność powstałego koloru zielonego jest wprost proporcjonalna do stężenia amoniaku w próbce.

Sonda do pomiaru gazów
Elektroda amoniaku mierzy amoniak gazowy w roztworach wodnych lub jony amonowe, które zostały przekształcone w gaz poprzez dodanie mocnej substancji bazowej. Elektroda jest kompletnym elektrochemicznym ogniwem składającym się ze szklanej elektrody pH i elektrody odniesienia. Membrana przepuszczająca gaz oddziela próbkę od cienkiej warstwy elektrolitu sprężonego między gruszką pH a membraną. Przy wysokim pH jony amonowe są przekształcane w amoniak gazowy. Gaz dyfunduje przez membranę i powoduje zmianę pH w cienkiej warstwie elektrolitu. Potencjał na szkle pH zmienia się w wyniku zmiany pH, a elektroda mierzy zmianę potencjału. Zmierzona zmiana pH jest proporcjonalna do stężenia amoniaku w roztworze.
Online:
Metoda Nesslera
W badaniu amoniaku odczynnik Nesslera (K 2H gI4) reaguje z amoniakiem obecnym w próbce (w warunkach silnie alkalicznych), zabarwiając próbkę na żółto. Intensywność barwy jest bezpośrednio proporcjonalna do stężenia amoniaku.
2K 2HgI 4 + NH 3 + 3KOH → Hg 2OINH 2 + 7KI + 2H 2O
Rozwiązanie stacjonarne:
Rozwiązanie przenośne:
Zestaw do testowania amoniaku NI-8
Online:
Często zadawane pytania
Jakie metody mogą być stosowane w przypadku raportowania zawartości amoniaku w ściekach?
Azot amonowy można mierzyć za pomocą spektrofotometru (lub kolorymetru) lub elektrody jonoselektywnej (ISE). Poniżej przedstawiono przyjęte lub równoważne metody analizy ścieków stosowane przez amerykańską Agencję ochrony środowiska (USEPA).
Azot-amoniak, metoda Nesslera 8038 - akceptowana przez USEPA do analizy ścieków (wymagana destylacja), metoda 350.2.
Azot-amoniak, metoda TNTplus 10205 - odpowiednik
Azot-amoniak, metoda elektrody jonoselektywnej (ISE) 10001 i 10002 - Procedury te można wykorzystywać w standardowych metodach badania wody i ścieków 4500-NH3 E na potrzeby raportów dla USEPA NPDES.
Dlaczego odczynniki LCK zawierające salicylan amonu są równoważnymi metodami dla EPA, natomiast odczynniki salicylanowe TNT Amver nie są?
Testy kuwetowe amoniaku LCK LKC304, LKC303, i LKC305 są uważane za równoważne w analizowaniu i raportowaniu stanu ścieków do amerykańskiej Agencji ochrony środowiska (USEPA). Zestawy odczynników do oznaczania amoniaku TNT Amver nie są uważane za równoważną metodę raportowania USEPA.
Firma Hach opracowała metodę dostosowaną do wymagań EPA wraz ze związanymi z nią danymi, które zapewniają równoważność metodzie MUR i stanowi odczynników salicylanu amoniaku TNTplus®. Nie przyjęto tego podejścia w przypadku starszych odczynników salicylanowych TNT Amver. Jeśli użytkownik rozważa używanie starszych testów amoniaku TNT pod kątem zgodności z przepisami, może nadal skonsultować to ze swoim organem regulacyjnym.
Wzorcowa metoda dostosowana do wymagań EPA, "TNTplus amoniak – pomiar azotu amonowego i azotu ogólnego metodą Kjeldahla w wodzie i ściekach za pomocą spektrofotometru" zawierająca informacje na temat równoważności USEPA względem 350.1 i 351.1.
Czy metody Nesslera i salicylanu wykrywają amoniak lub amon?
Zarówno metoda Nesslera, jak i salicylanowa opierają się na reakcji z amoniakiem molekularnym w roztworze podstawowym. Jeśli pierwotna próbka zawiera jony amonowe, odczynniki podstawowe przekształcą je w amoniak molekularny, a następnie nastąpi reakcja, co przyczyni się do uzyskania końcowego wyniku testu. Jednak te proste testy amoniaku nie obejmują amoniaku, który występuje w grupach aminokwasów wiązanych organicznie. Prawdziwy test amoniaku ogólnego obejmuje chloraminy i wymaga podgrzania próbki w roztworze kwasowym w celu strawienia organicznego amoniaku.
Ponieważ wynik testu jest sumą amoniaku cząsteczkowego (NH 3) i jonów amonowych (NH 4 -), preferowaną jednostką do raportowania jest azot (NH 3 -N). Większość kolorymetrów i spektrofotometrów firmy Hach ma możliwość konwersji wyników testów między azotem, amoniakiem i amonem. Nie powoduje to zmiany oznaczanego parametru chemicznego testu; a jedynie zmianę jednostek. Należy zauważyć, że mimo iż ilość azotu w amoniaku i amonie jest taka sama, stosunek stechiometryczny N do NH 3i NH 4 + nie jest dokładnie taki sam ze względu na różną liczbę atomów wodoru.
- Aby dokonać konwersji z mg/L NH 3 -N na mg/L NH 3, należy pomnożyć uzyskaną wartość przez 1,216.
- Wartość obliczona z masy NH 3 podzielona przez masę N (17,034 ÷ 14,01 = 1,216).
- Aby dokonać konwersji z mg/L NH 3 -N na mg/L NH 4, należy pomnożyć przez 1,288.
- Wartość obliczona z masy NH 4 + podzielona przez masę N (18,042 ÷ 14,01 = 1,288).
Co właściwie mierzy analizator Amtax sc?
Gdy pomiar jest wyświetlany na analizatorze Amtax sc, jednostką jest „NH 4 -N” lub „NH 4”, co oznacza, że pomiar w urządzeniu jest wyrażony jako amon i urządzenie podaje wartości jako azot (określony również jako „NH 4jako N”) lub amon. Nie ma różnicy między wyrażaniem stężenia amoniaku („NH 4 -N” lub „NH 3 -N”), ponieważ w obu przypadkach jest ono obliczane jako azot, którego ilość jest taka sama w obu przypadkach postaci amonu.
Analizator Amtax sc dodaje wodorotlenek sodu (NaOH) w celu dostosowania pH i przekształcenia jonów amonowych (NH 4 +) w amoniak gazowy (NH 3), który przechodzi przez membranę selektywną gazu amoniakalnego i powoduje zmianę pH roztworu elektrolitu. Zmiana pH elektrolitu jest mierzona jako sygnał mV proporcjonalny do stężenia amoniaku (NH 3) w próbce.
Jakie stężenie amoniaku jest toksyczne dla ryb?
Amoniak występuje w wodzie jako jony amonowe (NH 4 +) lub niezjonizowany amoniak (NH 3). Niezjonizowany amoniak jest toksyczny dla ryb, podczas gdy jony amonowe nie są toksyczne, z wyjątkiem bardzo wysokich stężeń. Przy neutralnym pH 7 i temperaturze otoczenia prawie cały amoniak występuje jako NH4+. Wraz ze wzrostem pH i temperatury zwiększa się ilość NH 3 i maleje ilość NH4+.
Aby zmierzyć stężenie niezjonizowanego amoniaku w próbce, należy wykonać następujące czynności:
- Zmierzyć stężenie amoniaku przy użyciu dowolnej metody mierzenia amoniaku, z wyjątkiem metody wolnego amoniaku.
- Zmierzyć pH i temperaturę próbki. Patrz tabela zatytułowana „Zawartość procentowa niezjonizowanego amoniaku w roztworze wodnym według wartości pH i temperatury obliczonej na podstawie danych z firmy Emerson, et. al*” na stronie 11 w podręczniku Zestawu testowego dla akwakultury słodkowodnej FF2..
- Określić wartość procentową NH 3 z wykorzystaniem tabeli, wartości pH próbki i temperatury próbki.
- Pomnożyć stężenie amoniaku przez wartość procentową z tabeli, a następnie podzielić przez 100.